¿Soy pura química?
Si esta noche sus niveles de testosterona se elevan considerablemente, se lanzará en busca de una aventura amorosa.
¿Y si no tengo éxito?
El “así no me puedo ir a casa” es un mito, la testosterona sube y baja. Pero si tiene éxito disfrutará del subidón de dopamina, la hormona del placer. Y si el sexo ha sido bueno, querrá repetir y al despedirse de su amante puede que note el bajón de serotonina y piense: “Qué especial es esta persona”...
¿Amor?
Quizá tras varios chutes de dopamina esté un poco enganchada, pero si aparece la oxitocina está perdida, su cerebro la segrega en cantidad en cada orgasmo y es la responsable del apego: estar juntos aumenta la confianza y reduce el estrés.
Qué bonito.
No se confíe, asegúrese de mantener los niveles de oxitocina altos a base de orgasmos si no quiere que el apego vaya decreciendo. El drama aparece cuando una relación se rompe por alguna de las dos partes con los índices de oxitocina al máximo.
¿Depresión y obsesión química?
Sí, la serotonina está por los suelos y tus neuronas encargadas del placer ya no segregan dopamina: sufres síndrome de abstinencia; desesperado, tu cerebro pide volver a ver al amado; pero si él no corresponde, abstente, insistir es un suicidio hormonal.
¿Si lo veo, la química se reactiva?
Sí, cualquier neurocientífico experto en adicciones le dirá que la mejor terapia para el desamor es borrar su teléfono.
¡Menudo drama hormonal!
Hay muchos ejemplos que demuestran que la química va por delante de la conducta. La libertad es una ilusión del cerebro. Antes de decidir cualquier cosa, hay unos procesos inconscientes que dan lugar a esa decisión.
Ya que somos química, deme química para estimular la inteligencia.
Participé como voluntario en un estudio del Instituto Nacional de Salud de EE.UU. que demostraba que la estimulación eléctrica transcraneal hace que aprendas más rápido.
¿Para cuándo su comercialización?
Una de cada cinco personas que toman Ritalin (fármaco para tratar el déficit de atención) no tiene ningún problema de salud. La mayoría son científicos y académicos que quieren mejorar su rendimiento intelectual.
Hemos pasado del determinismo genético al químico.
Investigadores del MIT, como Ed Boyden, reconocen poseer herramientas que cambiarán nuestros cuerpos, mentes e identidades a una velocidad nunca vista.
El humano ciborg ya es una realidad.
Al ingeniero Hugh Herr le amputaron las dos piernas y se puso a trabajar con prótesis; es el padre del tobillo electrónico más avanzado del mundo. Sus piernas ortopédicas le permiten subir paredes con más agilidad que antes y presumir: “Cuando tenga 80 años mis tobillos serán igual de buenos, pero los suyos estarán muy deteriorados”.
Fascinante.
Se está investigando la conexión de la actividad neural con una interfaz que permite interactuar con una pantalla de ordenador. Un parapléjico puede con el pensamiento situar el cursor donde le convenga.
Y la moral ¿también es pura química?
La moralidad tiene un sustrato neurobiológico. No necesitamos que nadie nos explique que matar es malo, lo llevamos insertado de manera innata en las áreas más profundas de la emoción, y florece inconscientemente como los miedos, el hambre o la gramática. Nuestros pensamientos y acciones no dejan de ser impulsos químicos en nuestro cerebro.
El cerebro es la estructura más compleja del universo.
Sí, cien mil millones de neuronas interconectadas. Un prodigio de la evolución, ¡pero, ojo!, el cerebro detesta la incertidumbre y si los sentidos no le dan suficiente información, se la inventa, mezcla memorias reales con recuerdos imaginados para que las historias rememoradas sean plausibles. La duda tampoco le gusta y se aferra a la realidad subjetiva que más le convenga.
Muy humano.
Haga la prueba, intente reconstruir en detalle el momento de su desayuno, ¿se ve a sí misma sentada o caminando por el comedor como si hubiera una cámara en un rincón? Si ve eso, no hay duda de que su cerebro se ha sacado esa imagen de la neurona.
Cerebro complejo y mentiroso.
Si tras conocer unos minutos a alguien que nos ha gustado nos preguntan sobre él, respondemos con gran optimismo incluso a los aspectos de los que no tenemos datos. Hemos rellenado los huecos de información con expectativas.
... Así nos va.
En un estudio formaron dos grupos, uno con personas de autoestima muy alta y otro muy baja. Hicieron unas técnicas muy agresivas de pensamiento positivo y resultó que a los que tenían la autoestima baja les perjudicó, así que mantenga su ironía.
¿Alguna lección vital?
Una reflexión inesperada. Cuando llegó el nuevo director de los Institutos Nacionales de Salud quiso establecer un mapa de ruta muy ambicioso y todos le dijeron: “No es el momento” (andaban mal de presupuesto); pero él respondió: “No hay momento malo para hacer algo bueno”. Su mandato como director fue un éxito.


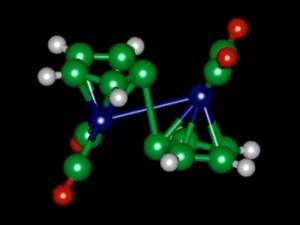 Un equipo de investigadores del MIT ha descubierto cómo exactamente actúa una molécula llamada fulvaleno dirutenio al almacenar calor y al liberarlo, dos procesos activables de manera artificial. Este conocimiento debería ahora hacer posible encontrar sustancias químicas similares en comportamiento, pero compuestas por ingredientes más abundantes y menos caros que el rutenio. Esto podría convertirse en la base para desarrollar una batería recargable que almacenase calor en vez de electricidad
Un equipo de investigadores del MIT ha descubierto cómo exactamente actúa una molécula llamada fulvaleno dirutenio al almacenar calor y al liberarlo, dos procesos activables de manera artificial. Este conocimiento debería ahora hacer posible encontrar sustancias químicas similares en comportamiento, pero compuestas por ingredientes más abundantes y menos caros que el rutenio. Esto podría convertirse en la base para desarrollar una batería recargable que almacenase calor en vez de electricidad Un equipo de científicos de Rusia y Estados Unidos ha detectado por vez primera al elemento superpesado conocido como elemento 117
Un equipo de científicos de Rusia y Estados Unidos ha detectado por vez primera al elemento superpesado conocido como elemento 117


